Comprendre sa fertilité : savoir pour mieux anticiper

La fertilité désigne la capacité naturelle d’un individu à concevoir un enfant. Elle dépend d’un ensemble de facteurs biologiques, hormonaux, physiques, mais aussi environnementaux et émotionnels. Chez la femme comme chez l’homme, la fertilité est une fonction dynamique, influencée par l’âge, l’état de santé global, le mode de vie, et le bon fonctionnement des organes reproducteurs.
Fertilité féminine
La fertilité féminine repose principalement sur :
- La réserve ovarienne : c’est le stock d’ovocytes encore disponibles dans les ovaires, qui diminue avec l’âge.
- La qualité de l’ovulation : une ovulation régulière et de bonne qualité est essentielle pour libérer un ovocyte fécondable.
- L’intégrité de l’appareil reproducteur : l’utérus, les trompes de Fallope et l’endomètre doivent être fonctionnels pour permettre la fécondation et l’implantation.
- L’environnement hormonal : les cycles menstruels doivent être équilibrés sur le plan hormonal (FSH, LH, estradiol, progestérone, AMH...).
Enfin, un élément essentiel à connaître lorsqu’on parle de fertilité féminine est la fenêtre de fertilité. Contrairement aux hommes qui peuvent concevoir n’importe quel jour, les femmes ne sont fertiles que quelques jours par cycle. L’ovulation – l’expulsion de l’ovocyte par l’ovaire – n’a lieu qu’une seule fois par cycle, et l’ovocyte ne survit que 12 à 24 heures. Pour qu’il y ait fécondation, un spermatozoïde doit donc parvenir à sa rencontre dans ce court laps de temps.
Cependant, les spermatozoïdes peuvent survivre jusqu’à 5 jours dans l’appareil reproducteur féminin, lorsque les conditions sont favorables, notamment grâce à la glaire cervicale. Ce qui signifie qu’un rapport ayant lieu jusqu’à 5 jours avant l’ovulation peut potentiellement mener à une grossesse. Ainsi, la fenêtre de fertilité s’étend sur environ 6 à 7 jours autour de l’ovulation – en général les 5 jours précédents, le jour J, et parfois le lendemain.
Identifier cette période est crucial lorsqu’on souhaite concevoir. Pourtant, cette notion reste méconnue : seules 1 femme sur 10 sait précisément à quel moment de son cycle elle est la plus fertile. À noter aussi : chaque femme est différente, et il n’existe pas de règle universelle selon laquelle l’ovulation surviendrait au 14e jour du cycle. C’est une moyenne, pas une norme.
Fertilité masculine
La fertilité masculine repose principalement sur :
- La qualité du sperme : un spermogramme permet d’évaluer la concentration, la mobilité et la morphologie des spermatozoïdes.
- Le bon fonctionnement des testicules : ils doivent produire un nombre suffisant de spermatozoïdes viables.
- L’intégrité des voies génitales : épididyme, canaux déférents et vésicules séminales doivent permettre le transport du sperme.
- L’environnement hormonal et génétique : des déséquilibres hormonaux ou des anomalies chromosomiques peuvent altérer la spermatogenèse.
Hypofertilité
Mais la fertilité n’est ni figée, ni binaire. Elle évolue dans le temps, sous l’influence de nombreux facteurs — âge, santé, hygiène de vie, environnement, antécédents médicaux — et peut connaître des phases de fragilité ou de déclin progressif. C’est pourquoi il est essentiel de parler aussi d’hypofertilité : un état où la fertilité est affaiblie mais pas absente. On observe par exemple une ovulation irrégulière, une réserve ovarienne plus basse que la moyenne pour l’âge, une diminution légère de la qualité du sperme ou des cycles hormonaux déséquilibrés. Ce n’est pas une infertilité à proprement parler, mais une situation qui peut retarder ou compliquer une grossesse.
L’hypofertilité peut être liée à :
- Une légère baisse de la qualité ovocytaire ou spermatique
- Un dérèglement hormonal ponctuel
- Un mode de vie défavorable à la fertilité (stress chronique, alimentation déséquilibrée, tabac, surpoids…)
- Une pathologie débutante ou peu symptomatique
Investiguer les causes d’hypofertilité est essentiel, car cela permet d’intervenir en amont d’une infertilité installée, grâce à une approche préventive, intégrative et personnalisée.
Infertilité
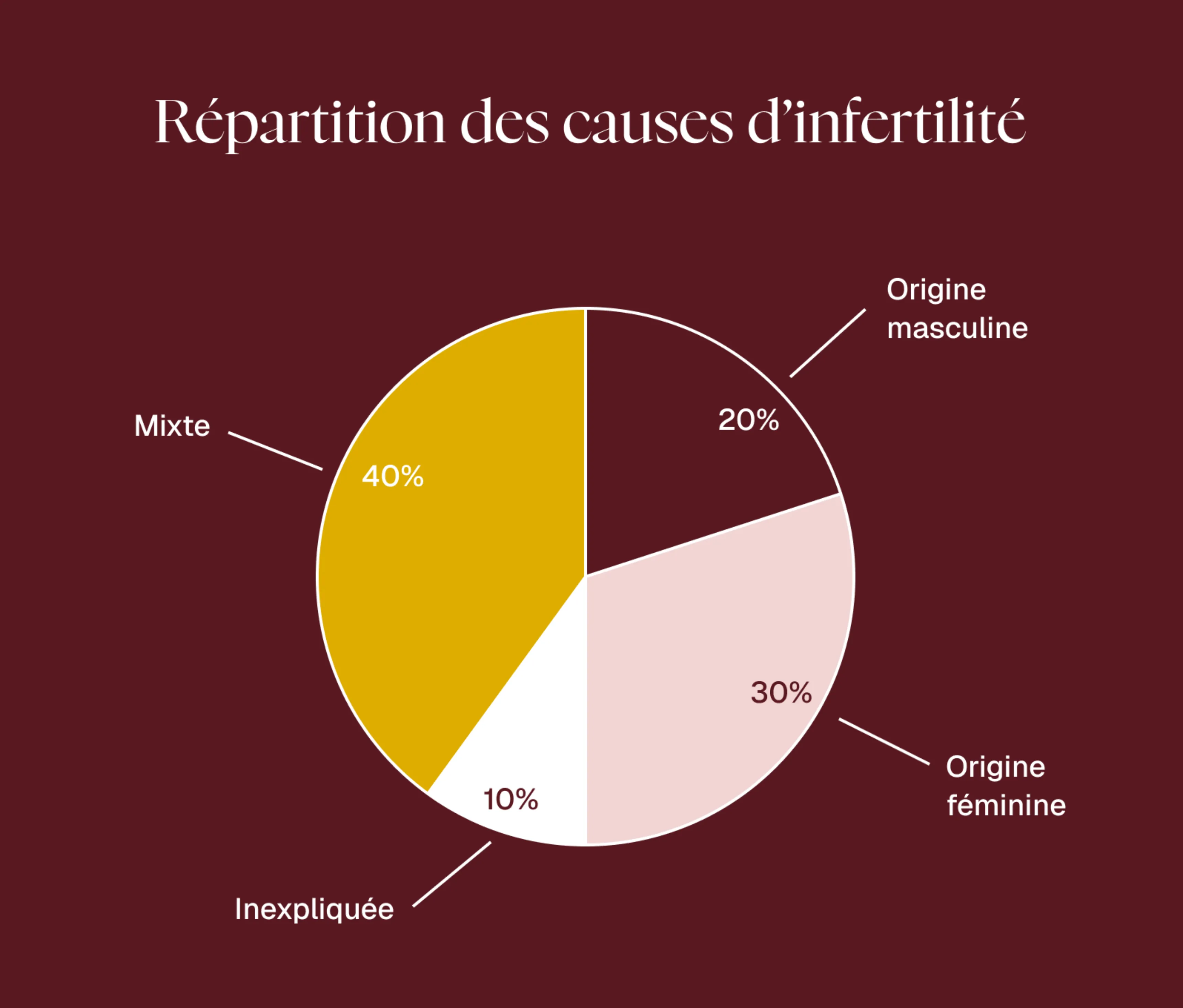
L’infertilité, elle, est définie par l’Organisation Mondiale de la Santé (OMS) comme l’impossibilité de concevoir après 12 à 24 mois de rapports sexuels réguliers et non protégés. C’est une situation qui concerne aujourd’hui 1 couple sur 6 dans les pays industrialisés. Elle peut être féminine, masculine, mixte (les deux partenaires), ou encore inexpliquée (aucune cause identifiée malgré les examens).
Lorsqu’aucune cause évidente n’est identifiée lors du bilan de fertilité médical, une approche paramédicale peut venir en complément pour explorer d’autres pistes. Dans d’autres cas, l’infertilité nécessite une prise en charge médicale plus avancée (PMA, FIV, ICSI…).
L’infertilité ne doit pas être confondue avec la stérilité, qui désigne une incapacité totale à concevoir sans assistance médicale — par exemple en cas de trompes bouchées ou d’azoospermie (absence de spermatozoïdes dans le sperme). Heureusement, des solutions existent : procréation médicalement assistée (PMA), don de sperme ou don d’ovocytes, selon les situations. L’innovation joue également un rôle croissant, avec notamment l’intelligence artificielle capable aujourd’hui d’identifier un spermatozoïde mobile unique, ouvrant de nouvelles possibilités pour certains cas d’infertilité masculine sévère.
En effet, elle n’implique pas nécessairement une impossibilité définitive de concevoir, mais signale une difficulté à y parvenir naturellement dans un délai raisonnable. Elle peut être transitoire, partielle ou liée à des facteurs modifiables (poids, stress, tabac, exposition aux perturbateurs endocriniens, etc.).
Les causes de l’infertilité
1. Le facteur âge : la première cause d'infertilité aujourd'hui
- L’infertilité est naturellement liée au temps : la fertilité féminine décline dès 30 ans, plus brutalement après 35 ans.
- Chez l’homme, la qualité du sperme baisse aussi avec l’âge, avec une chute significative après 45 ans.
- En Belgique, l’âge moyen à la naissance du premier enfant est passé d’environ 24 ans dans les années 1970 à 29,6 ans en 2022, soit une augmentation de près de 5 ans en 50 ans.
Ce recul de l’âge à la parentalité est aujourd’hui identifié comme le principal moteur de l’augmentation de l’infertilité dans les pays industrialisés.
20% des femmes n'ont pas conscience des effets négatifs du vieillissement sur la fécondité
2. Le mode de vie : un levier souvent sous-estimé
- L’alimentation, le stress, l’activité physique, le sommeil, les addictions ou encore l’exposition aux perturbateurs endocriniens jouent un rôle déterminant dans la santé reproductive, tant chez la femme que chez l’homme.
- Plusieurs facteurs de mode de vie ont un impact direct sur les gamètes, sur les différentes étapes de la fécondation, et sur le développement embryonnaire et fœtal :
- désordres pondéraux (surpoids, obésité),
- troubles métaboliques et nutritionnels (alimentation carencée en micronutriments),
- troubles du sommeil,
- consommation d’alcool, de tabac, de cannabis, de café en excès,
- stress chronique.
- L’obésité, en particulier, est un facteur de risque reconnu :
- Chez la femme, elle allonge le délai de conception, altère la fertilité naturelle et réduit les chances de succès en FIV.
- Chez l’homme, elle altère la qualité du sperme sur tous les paramètres (quantité, mobilité, morphologie).
- Le tabac est toxique pour les ovaires et les testicules : il diminue la réserve ovarienne et augmente le stress oxydatif sur les spermatozoïdes.
- Le cannabis, via des récepteurs présents dans les organes reproducteurs (ovaires, testicules, hypophyse, utérus), perturbe les cycles hormonaux, l’ovulation, la spermatogénèse et l’implantation embryonnaire.
- L’alcool, encore trop banalisé, retarde le délai de conception de plusieurs mois et double le risque d’infertilité pour les deux sexes selon les études disponibles.
- L’impact des perturbateurs endocriniens est massif : présents dans les plastiques, cosmétiques, pesticides, meubles, produits d’entretien, ils altèrent la fertilité, parfois de manière transgénérationnelle. Leur effet ne dépend pas nécessairement de la dose mais de la fréquence d’exposition et de l’effet cocktail entre substances. Le BPA, les phtalates, les parabènes ou les perfluorés sont retrouvés dans le sang et les fluides corporels humains, avec des conséquences telles que puberté précoce, endométriose, anomalies ovariennes ou baisse de la concentration spermatique.
En pratique, des gestes simples peuvent faire la différence :
- Adopter une alimentation de type méditerranéenne, riche en fibres, bons gras, fruits et légumes frais, poissons gras et céréales complètes.
- Pratiquer une activité physique régulière (au moins 30 minutes par jour).
- Dormir suffisamment, à horaires réguliers.
- Réduire ou arrêter le tabac, le cannabis, l’alcool.
- Limiter l’exposition aux polluants : utiliser des contenants alimentaires sans plastique, choisir des cosmétiques sans perturbateurs endocriniens, bien aérer son logement.
- Apprendre à gérer le stress, via des techniques de relaxation, une bonne hygiène de vie, voire un accompagnement psychologique.
L’hygiène de vie est un levier puissant pour améliorer naturellement sa fertilité, prévenir l’infertilité, et maximiser les chances de réussite d’un parcours de PMA.
En complément d’un suivi médical, plusieurs approches holistiques peuvent aussi jouer un rôle clé pour préparer le terrain en amont d’un projet de grossesse ou d’un parcours de fertilité :
- La naturopathie, en agissant sur le terrain global (digestion, inflammation, détoxication, stress), vise à rééquilibrer naturellement l’organisme.
- La nutrition fonctionnelle, individualisée et ciblée, permet de corriger les carences, soutenir l’équilibre hormonal et améliorer la qualité ovocytaire et spermatique.
- La symptothermie, une méthode d’observation du cycle basée sur les signes biologiques naturels (température, glaire cervicale, col de l’utérus), permet quant à elle de repérer avec précision la fenêtre de fertilité et de mieux comprendre son rythme hormonal.
- D’autres disciplines comme la sophrologie, la réflexologie, ou encore l’acupuncture peuvent également accompagner le couple dans une approche plus globale et intégrative de sa fertilité.
En combinant médecine conventionnelle et accompagnements complémentaires, il est possible d’agir à la fois sur les causes visibles et invisibles de l’infertilité, et de redonner toute sa place à la prévention dans les parcours reproductifs.
{{cta-gyneco}}
3. Les pathologies affectant la fertilité chez la femme
1. Endométriose
L’endométriose est une maladie inflammatoire chronique qui concerne entre 6 et 10 % des femmes. Elle se manifeste principalement par des douleurs souvent intenses et invalidantes, en particulier pendant les menstruations, et peut également être à l’origine de troubles de la fertilité dans un certain nombre de cas.
Les mécanismes par lesquels l’endométriose altère la fertilité sont multiples et encore en partie controversés. Ils peuvent affecter toutes les étapes du processus reproductif :
- des troubles de l’ovulation,
- une altération de la fécondation ou du transport des gamètes,
- jusqu’à des difficultés d’implantation embryonnaire.
Une forme particulière, l’adénomyose (endométriose interne à l’utérus), perturbe directement la cavité utérine, ce qui peut nuire à l’implantation de l’embryon. D’autres effets plus mécaniques peuvent également gêner la fertilité, comme les adhérences péritubo-ovariennes ou les lésions annexielles qui entravent la rencontre entre spermatozoïde et ovocyte.
{{cta-gyneco}}
2. Syndrome des ovaires polykystiques (SOPK)
Le SOPK est un trouble hormonal fréquent affectant environ 1 femme sur 10 en âge de procréer.
Contrairement à son nom, les clichés échographiques montrent des follicules en « attente » plutôt que de vrais kystes : des petits follicules immatures restent bloqués avant l’ovulation.
Critères de diagnostic (critères de Rotterdam)
Pour poser un diagnostic, deux des trois critères suivants doivent être remplis :
- Ovaires multi folliculaire (+ de 12 follicules par ovaire et AMH souvent élevée).
- Anovulation ou cycles irréguliers (cycles > 35 jours voire aménorrhée pendant > 3 mois).
- Hyperandrogénie, clinique (acné, hirsutisme, chute de cheveux) et/ou biologique.
Autres aspects fréquemment associés
- Insulinorésistance : le pancréas compense en produisant plus d’insuline, exacerbant la production d’androgènes
- Troubles métaboliques : surcharge pondérale, diabète de type 2, risque cardiovasculaire
- Inflammation chronique : peut aussi contribuer au syndrome
Pourquoi le SOPK peut‑il entraîner une infertilité ?
- Ovulations rares ou absentes du fait d’un pic LH décalé et d’un excès d’androgènes ; cela réduit mécaniquement les cycles propices à la conception
- Phase lutéale insuffisante : le corps jaune peut mal fonctionner, la sécrétion de progestérone est trop faible, ce qui peut empêcher la nidation
- Qualité ovocytaire altérée, en lien avec l’inflammation et le stress oxydatif, affectant la fécondation et le développement embryonnaire
Le SOPK la première cause d’infertilité féminine, mais infertilité ne veut pas dire stérilité : jusqu’à 60 % des femmes avec SOPK tomberont naturellement enceinte en moins d’un an.
- Le SOPK est un syndrome multifactoriel aux origines hormonales, métaboliques et héréditaires/épigénétiques
- Il peut ralentir la fertilité, mais n’empêche pas forcément la grossesse.
- L’association d’une approche globale (alimentation, sport, gestion du stress), d’un bon suivi de l’ovulation (symptothermie) et d’un soutien médical ciblé peut nettement améliorer les chances de concevoir.
{{cta-gyneco}}
3. Insuffisance ovarienne prématurée (IOP) / Réserve ovarienne basse
L’IOP désigne une perte de la fonction ovarienne avant 40 ans, souvent associée à :
- des troubles du cycle (aménorrhée ou cycles raccourcis),
- une AMH basse et une FSH élevée,
- une absence ou raréfaction de l’ovulation.
Une réserve ovarienne basse peut aussi exister sans IOP, y compris chez des femmes jeunes, et réduire les chances de grossesse spontanée.
{{cta-gyneco}}
4. Malformations utérines
Anomalies de la forme ou du développement de l’utérus (utérus cloisonné, bicorne, hypoplasique…), qui peuvent :
- empêcher l’implantation embryonnaire,
- favoriser les fausses couches,
- rendre les grossesses plus à risque.
{{cta-gyneco}}
5. Fibromes utérins (myomes)
Tumeurs bénignes de l’utérus, fréquentes après 35 ans.
Lorsqu’ils sont :
- sous-muqueux (déformant la cavité utérine),
- ou de grande taille,
Ils peuvent gêner l’implantation ou la vascularisation de l’embryon.
{{cta-gyneco}}
6. Infections génitales non traitées
Infections comme les chlamydiae, gonocoques, ou des infections post-chirurgicales peuvent provoquer :
- des adhérences tubaires ou une obstruction des trompes ;
- des anomalies du col ou de l’endomètre ;
Conduisant à une infertilité tubaire ou utérine.
{{cta-gyneco}}
4. Les pathologies affectant la fertilité chez l'homme
1. Altérations du spermogramme
On parle d’oligospermie (baisse du nombre), asthénospermie (baisse de mobilité), ou tératospermie (anomalies de forme).
Ces anomalies peuvent être :
- isolées ou combinées,
- transitoires (fièvre, stress, prise de médicament),
- ou liées à une pathologie sous-jacente.
Le spermogramme est un examen de première intention.
2. Varicocèle
La varicocèle est une dilatation anormale des veines du testicule, généralement du côté gauche.
Elle entraîne :
- une élévation locale de la température,
- un stress oxydatif,
pouvant altérer la spermatogenèse (production de spermatozoïdes).
C’est la cause la plus fréquente d’infertilité masculine d’origine testiculaire.
3. Hypogonadisme ou troubles hormonaux
Le hypogonadisme hypogonadotrope (d’origine centrale) ou hypergonadotrope (testiculaire) provoque une altération de la production de testostérone et de spermatozoïdes.
Cela peut résulter :
- d’un défaut de stimulation hormonale (LH, FSH),
- ou d’un dysfonctionnement testiculaire primitif.
4. Lésions testiculaires, infections ou traitements
Des lésions des testicules (traumatismes, torsion, chirurgie) ou infections (oreillons, IST) peuvent détruire le tissu spermatogène.
Les traitements médicaux lourds (chimiothérapie, radiothérapie, immunosuppresseurs…) sont aussi hautement reprotoxiques.
5. Cryptorchidie (testicule non descendu)
La cryptorchidie désigne l’absence de descente d’un ou des deux testicules dans les bourses à la naissance. C’est l’anomalie génitale congénitale la plus fréquente chez le garçon (environ 3 % des nouveau-nés à terme, jusqu’à 30 % chez les prématurés).
Lorsque le testicule reste positionné en dehors du scrotum (généralement dans le canal inguinal ou l’abdomen), il est exposé à une température trop élevée, ce qui nuit à la spermatogenèse.
Si elle n’est pas corrigée chirurgicalement avant l’âge de 1 an, la cryptorchidie peut entraîner :
- une altération de la production de spermatozoïdes,
- une augmentation du risque d’azoospermie (absence de spermatozoïdes dans le sperme),
- et un risque accru de cancer du testicule.
Elle peut être unilatérale (avec impact partiel sur la fertilité) ou bilatérale (avec impact majeur). Même après correction, la fertilité peut rester altérée, notamment si la chirurgie a été tardive.
6. Vasectomie et tentatives de reperméabilisation
La vasectomie est une méthode de contraception masculine définitive qui consiste à sectionner ou bloquer les canaux déférents, empêchant ainsi les spermatozoïdes d’être éjaculés.
Bien que considérée comme réversible dans certains cas, le retour à la fertilité après une vasectomie n’est ni garanti ni systématique :
- La chirurgie de reperméabilisation (vasovasostomie ou vaso-épididymostomie) vise à reconnecter les canaux mais présente des taux de succès variables, surtout si plus de 10 ans se sont écoulés depuis l’intervention.
- Il peut persister une obstruction, une réaction immunitaire contre les spermatozoïdes (anticorps antispermatozoïdes), ou une altération de la spermatogenèse avec le temps.
Dans de nombreux cas, les hommes ayant eu une vasectomie doivent recourir à une ponction testiculaire de spermatozoïdes (TESE) pour accéder à une procréation médicalement assistée via FIV avec ICSI.
À retenir : la vasectomie est une cause d’infertilité volontaire mais parfois irréversible, et ses options de réversibilité doivent être bien évaluées au cas par cas.
Infertilité inexpliquée
L’infertilité inexpliquée désigne une situation où, malgré un bilan médical complet, aucune cause identifiable ne permet d’expliquer l’absence de grossesse après 12 à 24 mois de rapports réguliers et non protégés.
Elle concerne environ 10 à 20 % des cas d’infertilité féminine et 10 à 15 % des cas masculins, représentant jusqu’à un tiers des couples suivis en PMA.
Ce que les examens montrent comme normal
- Chez la femme :
- réserve ovarienne correcte (AMH, FSH, échographie ovarienne),
- ovulation régulière (cycles normaux, courbe de température, dosage de progestérone),
- utérus et trompes fonctionnels (échographie pelvienne, hystérosalpingographie ou HyFoSy),
- absence d’anomalie du col utérin ou de l’endomètre.
- Chez l’homme :
- spermogramme classique normal (concentration, mobilité, morphologie),
- bilan hormonal normal (testostérone, FSH, LH, prolactine),
- échographie testiculaire sans particularité,
- caryotype ou bilan génétique normal, si prescrit.
Pourquoi parle-t-on d’inexpliqué ?
Parce que nos outils diagnostiques actuels présentent des limites. L’infertilité inexpliquée peut cacher :
- Chez la femme :
- des troubles de l’ovulation discrets ou intermittents,
- des anomalies de qualité ovocytaire non détectables par les examens standards,
- une altération de la glaire cervicale, empêchant la progression des spermatozoïdes,
- un déséquilibre immunologique ou inflammatoire au niveau utérin,
- une réceptivité endométriale perturbée, non détectable sans examens spécialisés (test ERA).
- Chez l’homme :
- des anomalies fonctionnelles fines des spermatozoïdes (fragmentation de l’ADN, défauts membranaires, incapacité d’interaction avec l’ovocyte),
- un stress oxydatif élevé dans le sperme, invisible au spermogramme de base,
- des causes immunologiques (anticorps anti-spermatozoïdes),
- des facteurs environnementaux ou épigénétiques subtils.
Quel est le retentissement clinique ?
Même en l’absence de cause retrouvée, la fertilité peut être réduite :
- le temps nécessaire pour concevoir est souvent allongé,
- le taux de fécondation naturelle est diminué,
- les chances de succès en PMA peuvent être altérées,
- le risque de fausse couche, notamment lié à la qualité des gamètes, peut être augmenté.
Quelle prise en charge proposer ?
En l’absence de cause identifiée, l’accompagnement doit être personnalisé et multidimensionnel :
- Analyse fine du mode de vie : stress chronique, poids, activité physique, nutrition, environnement.
- Examens complémentaires : tests immunologiques, microbiote endométrial, recherche de troubles de la réceptivité utérine, fragmentation de l’ADN spermatique, tests de capacitation, évaluation du stress oxydatif.
- Approche holistique : acupuncture, micronutrition, hypnose, ostéopathie, soutien psychologique…
- Suivi pluridisciplinaire : andrologue, urologue, biologiste de la reproduction, gynécologue, praticiens paramédicaux.
- Recours à la PMA : insémination intra-utérine (IIU), FIV ou ICSI selon le contexte, l’âge de la patiente et la durée d’infertilité.
{{cta-alice}}
Conclusion : un enjeu global, multifactoriel et évolutif
La fertilité ne se résume pas à la capacité à concevoir « ici et maintenant ». Elle s’inscrit dans une dynamique à long terme, avec des phases de plus grande ou moindre fertilité au cours de la vie. Elle peut être fragilisée sans que cela signifie une infertilité définitive. Une approche globale, préventive et personnalisée permet aujourd’hui de mieux comprendre sa fertilité, d’en identifier les freins, et d’agir en amont — notamment grâce à des bilans de fertilité, des suivis pluridisciplinaires et des innovations médicales ou paramédicales.
{{cta-bilan-fertilite}}



.webp)
